Elettronica Grillo - Via N. Lombardi, 34 Mileto Vibo Valentia
Le Pile
LE PILE A COMBUSTIONE
IL Principio di Funzionamento Delle Cellule a Combustibile
Le cellule del combustibile sono semplicemente dei dispositivi che convertono il
combustibile (quali idrogeno, metano, propano, ecc.) direttamente in elettricità
elettrica. Il processo avviene tramite una reazione elettrochimica che è simile ad
una batteria. Diversamente delle batterie comunque, le cellule del combustibile non
immagazzinano l'energia con i prodotti chimici
internamente, ma la usano con un rifornimento
continuo di combustibile (prodotto chimico) da un serbatoio esterno.
La cellula originale
del combustibile è stata inventata nel 1839 dal sir William Robert Grove. È rimasto
una curiosità scientifica soltanto fino a che la NASA indicata unita (NASA) non la
sviluppasse per uso nel programma dello spazio degli Stati Uniti nel 1960. Le cellule
del combustibile convertono l' energia memorizzata in elettricità con risparmio di
temi circa 60-70%, con una alta efficienza.
ECCO COME FUNZIONANO:
Una cellula del combustibile lavora sul principio di base che quando un elemento
è ossidato chimicamente, unito con ossigeno), libera energia. La maggior parte delle
cellule del combustibile coinvolgono una reazione chimica semplice fra due materiali,
(un combustibile e un ossidante). I vari disegni funzionano usando molte combinazioni
differenti di fuel/oxidizer con essere più comune, idrogeno ed ossigeno.
In generale,
le cellule del combustibile richiedono un catalizzatore, che è un materiale che aiuta
la reazione chimica, ma non fa parte di esso. Ci sono molti tipi di catalizzatori,
ma per questa discussione, ci concentreremo su qualcosa chiamata " una membrana di
scambio protonico " (PEM)". Questo membrana è il catalizzatore, ovvero permette la
reazione chimica.
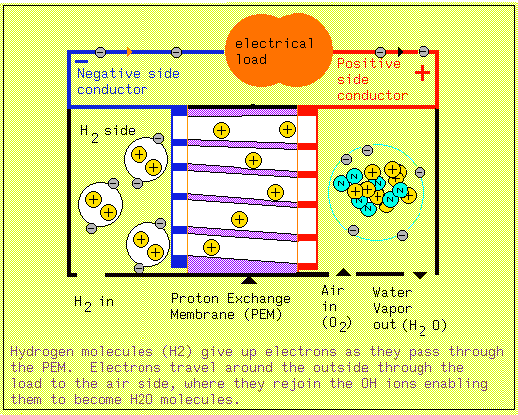
Nella cellula a combustibile basata sul PEM., l' idrogeno è inserito in un alloggiamento
sigillato, in cui una parete dell'alloggiamento è una parte della membrana del PEM
ricoperta del catalizzatore. L' altro lato della membrana del PEM anche, ricoperto
tipicamente di platino del catalizzatore, è esposto all' ossigeno (possibilmente
da aria). La membrana permette che i protoni dell' idrogeno vi passino attraverso,
ma non gli scarti come la più grande molecola di H 2.
Quando il singolo protone dell'
idrogeno attraversa la membrana, lascia un elettrone. Questi elettroni che sono rilasciati
possono essere raccolti in un conduttore. Gli elettroni concentrati in un conduttore
causano una tensione negativa potenziale su quel conduttore dovuto all' eccesso di
elettroni (elettroni sono cariche negative). La parte posteriore della membrana (PEM)
è un secondo alloggiamento che permette che l' ossigeno (o l' aria) raggiunga il
PEM. Quando la molecola radicale dell'ossigeno (o) viene a contatto del protone dell'
idrogeno (H+), uniscono facilmente per produrre l'OH (H2o). Questa combinazione tuttavia
richiede gli elettroni a farla accadere.Gli elettroni necessari possono essere forniti
da un secondo conduttore che può fornire gli elettroni. (naturalmente può fornire
soltanto gli elettroni se ha qualcuno da risparmiare).Con i 2 conduttori ora sulla
cellula, (il conduttore dell' idrogeno ha un eccesso di elettroni e l'ossigeno non
ha bisogno di alcuno) un potenziale elettrico esiste fra i 2. Il risultato netto
è positivo per ossigeno e la negazione per idrogeno.
Il processo di reazione è: 4H2
+ ê + Ò2 - ê = 2HÒ = calore (perdite) + energia elettrica.
Poiché l' energia elettrica
è usata mentre gira intorno al ciclo, gli unici sottoprodotti di questa disposizione
sono vapore acqueo e calore persa con inefficienza della cellula in se, o circa 30%
della potenza. Con un risparmio di temi 70%, questo processo è sensibilmente di più
attraente per l' estrazione dell' energia memorizzata che un motore a combustione
interna che estrae
tipicamente soltanto circa 20-30% dell' energia memorizzata del
combustibile
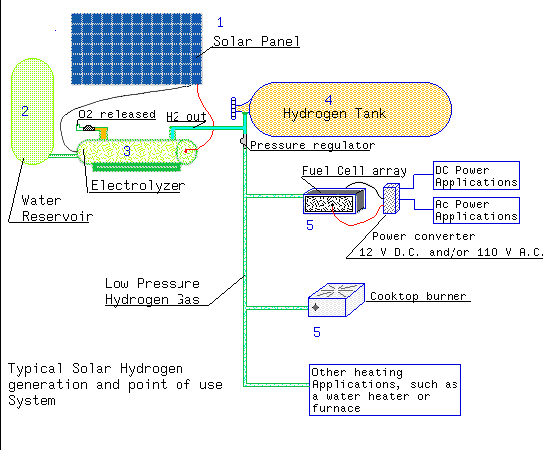
Questa illustrazione mostra un generatore basato sull'idrogeno. Il sistema indicato sopra ha parecchie conversioni di energia per permettere l'immagazzinamento dell' energia.
- Le cellule foto voltaiche convertono la luce solare direttamente in elettricità (corrente solitamente continua o corrente continua). L' energia sotto forma d'elettricità può essere spostata facilmente e concentrata, ma essere memorizzata non facilmente, in modo da è spostata verso il sistema di elettrolisi quando la memoria è necessaria.
- L' acqua è necessaria nel electrolyzer per la conversione chimica.
- L' elettrolisi converte l' energia elettrica in energia chimica sotto forma d'idrogeno
via il
electrolyzer. Questa fase è importante, poiché l'idrogeno può essere memorizzato così come mosso, o concentrato. Per i sistemi più semplici, l'ossigeno (O2) che ugualmente è analizzato dall'acqua (HÒ) è liberato semplicemente di nuovo all'atmosfera. Per effettuare la pressione nel sistema, un regolatore di pressione è usato per limitare il flusso ed effettuare un' più alta pressione dell'ossigeno nel electrolyzer.
- L' idrogeno è un gas ed in modo da la memoria è compiuta comprimendolo e forzandolo in un serbatoio per abbassare il volume richiesto. Il processo di elettrolisi può pressurizzare il serbatoio sopra una gamma limitata come indicata. Se le più alte pressioni sono necessarie, deve essere compresso da una pompa del compressore. Una valvola unidirezionale impedisce l'idrogeno pressurizzato andare di nuovo al sistema di elettrolisi. Un regolatore di pressione dal lato dell' uscita del serbatoio dell' idrogeno cade l' più alta pressione di memoria ad una pressione più bassa (typ. < 10 PSI) per uso.
- L' idrogeno può essere usato in una varietà di modi:
- Convertito in corrente elettrica in una cellula del combustibile. L' elettricità prodotta è energia concentrata e può più ulteriormente essere convertita in corrente continua o di CA.
- Convertito in energia termica in un bruciatore per cucinare
Questo uso dell' idrogeno completa il ciclo di energia, unendo l' idrogeno con l'ossigeno, e così restituendo solamente acqua.